Topics
2021.09.30 circular No.17
LCST型相転移挙動を示すイオン液体の利用;IL-MEBを中心に東京農工大学大学院・工学研究院・生命機能科学部門
中村 暢文
イオン液体は大変魅力的な研究対象であるが、中でも、下限臨界溶解温度(LCST)型相転移挙動(図1)について、私自身が溶液の化学や相転移挙動についての知識が無かったため、かえって大変興味を持った。LCST型相転移挙動については、高分子系での研究は以前から報告されており、すでにかなり進んでいたらしいが、高分子の研究にも疎かったため、当時は全く知らなかった。2007年に低分子のイオン液体でLCST型相転移挙動を示すアミノ酸イオン液体が報告されたとき1、非常に興味深い現象だとは思ったものの、単にそのイオン液体が水に溶けるときに吸熱する塩だからなのではないか、とか、単に飽和溶解度が、温度が上がると急激に下がる塩で、溶け残ったイオン液体が飽和水溶液と分離しているというだけの話かな、などと思っていた。温度を上げて二相に分離したときに、上層にも下層にもイオン液体と水がかなりの量含まれているというデータを見たときに、何故二相に分離しているのか、全く理解できなくなり、自分の中では、考えるのを停止し、しばらくほったらかしにしておこうと決めた。その後も、親疎水性を系統的にコントロールしたイオン液体が片っ端から調べられ、水とどのような比で混合しても相溶するイオン液体と、逆にどのような混合比であっても常に二相に分離しているイオン液体の間にLCST型相転移挙動を示すものがあることが明らかにされた2。その後、LCST型相転移挙動について、計算科学などをもとに、長距離に及ぶ相互作用や水分子とイオン液体の構成イオンによる構造形成など、段々見えてきているように思われるが、まだ詳細にはわかっていないというのが現状ではないかと思う。このトピックスでは、原理はともかく、このほんのわずかな温度変化で迅速に一相と二相の相変化が起こる面白い現象を何かに応用できないかと考え、これまで細々と進めてきた研究についてご紹介したい。まだ研究途上で、結果を論文にできていないことが大部分なので、考察が十分でないことだらけだが、ご容赦いただきたい。イオン液体研究会の中には多くの溶液化学の専門家もいらっしゃるので、このトピックスを読んで、何か共同研究していただける方がいらっしゃれば、是非お願いしたいと考えている。
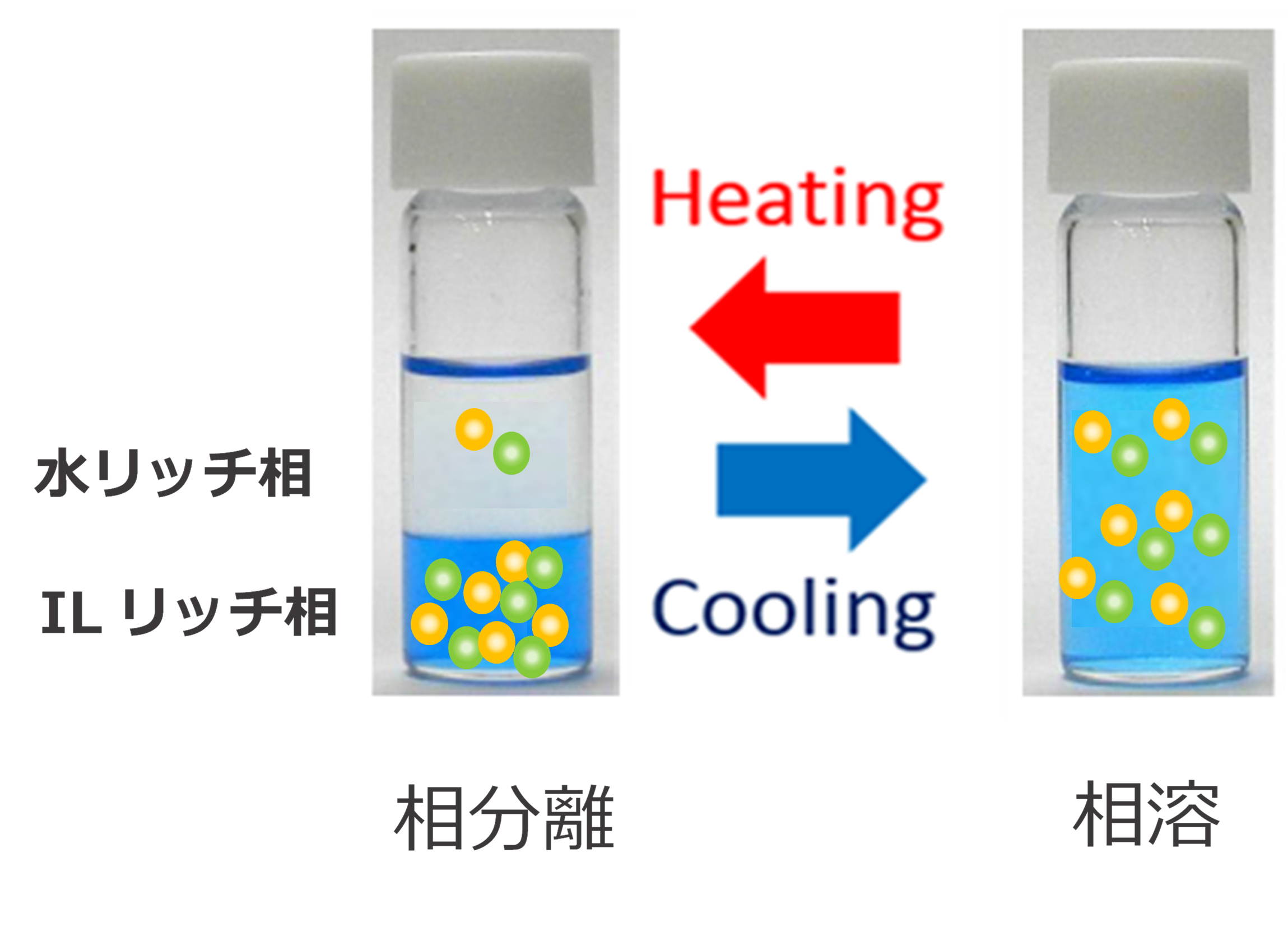
図1 下限臨界溶解温度(LCST)型相転移挙動。昇温したときに二相に分離する。上層、下層のどちらにもイオン液体と水は含まれる。
2.タンパク質の酸化還元に伴う相移動タンパク質などの生体高分子の溶媒としても、イオン液体は面白い。これまで、イオン液体中の酵素反応やタンパク質の挙動についても多くの研究がなされてきている。中でもタンパク質を安定に溶解することのできる水和イオン液体についての研究は、イオン液体ならではという意味で特筆に値する3-5。LCST型相転移挙動とタンパク質を組み合わせた研究の最初は、酸化体のシトクロムc(電子伝達タンパク質)のLCST型相転移挙動を経た迅速な相間移動の研究である6。タンパク質の種類によって、塩溶や塩析と言われるように、水溶液の塩濃度によって溶液への溶解性が変化するため、そのことを利用できれば、複数のタンパク質を瞬時に分離することも可能である7。シトクロムcの酸化体は特定のイオン液体濃度のイオン液体水溶液で塩析し、シトクロムcの還元体は塩析効果を示さず常に水層に溶解しやすいことから、電気化学的な酸化還元応答と温度変化という二種類の外部刺激によって、相間の移動をコントロールすることができる8。図2に、その挙動について示す。二種の外部刺激による可逆的な相間移動は何かに使えるのではないかと思っているが、今のところ良いアイディアが無い。
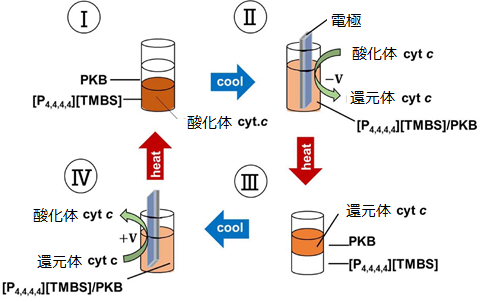
図2 酸化還元と熱による、シトクロムcの相間移動制御。この条件では、還元体のシトクロムcは水相に溶解しやすく、酸化体のシトクロムcはイオン液体相に溶解しやすい。
3.混合エントロピー電池(MEB)LCST前後で大きく変わるのは、イオン液体の濃度で、短時間に大きく濃度が変わることが、何かに応用できないかとずっと考えていたところ、La Mantiaらによって最初に提唱された混合エントロピー電池(Mixing Entropy Battery: MEB)9というエネルギー変換デバイスがあることを偶然見つけた。イオン液体/水混合系のLCST型相転移挙動を利用したMEB(IL-MEB)が作製できるのではないかと考え始めてからもう6年もたってしまったが、いまだにまとまっておらず、我々の研究だけではここで書くだけの材料がないので、これまでに提唱されている塩濃度差を利用した発電についても併せてご紹介したい。
3-1. 塩濃度差を利用した発電近年では太陽光や太陽熱、水力、風力、バイオマス、地熱などの再生可能エネルギーを利用した発電が大変注目を集めている。その再生可能エネルギーの中で海洋のエネルギーを利用するものはブルーエネルギーとも呼ばれ、海流、潮流、風、波、温度差などを利用する方法が考案されている10-12。ブルーエネルギーの一つとして、海水と河川水の間の濃度差エネルギーを利用した発電方法(狭義のブルーエネルギー)もいくつか報告されている。河口付近では潮の満ち引きで、余分なエネルギーを加えることなく塩濃度差を生み出すことができる。従来から存在する浸透圧発電(Pressure Retarded Osmosis: PRO)13と逆電気透析発電(Reverse Electro-Dialysis: RED)14に加え、2009年にBrogioliらが新たに提案したキャプミクス(Capacitive Mixing: CAPMIX)15と呼ばれる発電の方法がある。このCAPMIXの最大の特徴はPROとREDのように膜を使うことなく、溶液中に2本の電極を挿入しエネルギーを生み出すことである。このCAPMIXの原理を利用した発電はさらに3つの方法に分かれてきている。Capacitive Double Layer Expansion: CDLE15、Capacitive Donnan Potential: CDP16、および、今回我々が着目しているMixing Entropy Battery: MEB9 (混合エントロピー電池)である。CDLE、CDPとMEBにおいては、その発電原理は大きく異なり、前者2つは電気二重層の原理を、後者は化学反応を基に発電を行う。まずはこれらの塩濃度差発電について紹介する。 3-1-1. 浸透圧発電(PRO)
PROとは、塩水と淡水間の塩濃度差により発生する浸透圧を利用した発電方法であり、その原理は1976年にLoebにより提唱された13。海水と淡水の間に半透膜をおき、その浸透圧差により淡水が半透膜を浸透して海水側に移行することにより、増量した海水側の出口に水車発電機を設置してエネルギーを電力として回収するというものである。この発電方法は、燃焼や化学反応を利用しないため、環境に負荷を与えず、CO2の削減効果も高く、風力や太陽光のような気象の影響が少なく稼働率が高いクリーンな新エネルギーであると考えられた。また、河川から海への流れ込みがある人口が密集した大都市にも設置でき、送電時に発生するロスも抑えることができるといったこともメリットの1つとして挙げられている。2009年にStatkraft社はノルウェーのトフテに世界初となるPRO実証プラントを開設したものの、発電電力は4 kWと小さく、また、より良いPRO膜の開発が困難であるということを理由に2013年末には撤退した。
3-1-2. 逆電気透析発電(RED)この発電方法はPROよりも歴史は古く、1954年にPattleによって提唱されたものである14。REDは電気透析(Electro Dialysis: ED)の逆のプロセスにより発電を行う方法である。海水中にはナトリウムイオン、カルシウムイオンなどの陽イオンと塩化物イオン、硫酸イオンなどの陰イオンが存在するが、EDでは陽イオンのみを選択的に通す陽イオン交換膜(CEM)と陰イオンのみを選択的に通す陰イオン交換膜(AEM)を1対として、これらを2つの電極間に数千対配置したスタックを用いる。このCEMとAEMの間に海水などの塩水を流し、2つの電極に電圧をかけると、スタックの出口からは濃縮された海水と淡水が出てくる。濃縮された海水については、これをさらに煮詰めることで食卓塩として利用し、淡水は飲料水として利用するのがEDである。REDはEDと逆のプロセスで、海水と河川水をCEMとAEM間のスペーサーに流すことで、CEMとAEMの両側に、電位を発生させる。2013年、REDstack社がオランダ北西の締め切り大堤防にREDテストプラントを建設した。このプラントでは、2.2 W/m2の世界最高出力を得たと報告されているが、流路汚染により、出力が3日で約半分に低下したとの報告もある。前節のPRO同様にREDにおいても膜を使用するために膜の汚染による出力の低下が課題となっており、原水前処理システム、汚染物質の洗浄方法の開発が必要不可欠となっている。
3-1-3. キャプミクス(CAPMIX)を用いた発電
先に述べたように、このキャプミクスには①CDLE、②CDP、③MEBの3種が報告されている。これらは、用いられている電極が異なり、発電あるいはエネルギー貯蔵の原理が異なる。特に CDLE、CDPとMEBにおいては、その発電原理が異なり、前者は電気二重層形成、後者は電極上(内)での酸化還元反応を利用している。
① CDLE
Brogioliらにより電気二重層の原理を基に塩濃度差から電気エネルギーを獲得するCDLEという発電法が考案された15。CDLEは、電極に活性炭電極を用い、その電極間に海水と淡水を交互に流すことができ、抵抗Rを通して電流が流れるように外部回路と断続的に接続が可能となるように設計されている。NaCl水溶液に挿入した電極間に電位をかけると、陽極側にCl-が、陰極側にNa+が移動し、電気二重層を形成する。この時の電気二重層の厚さはデバイ長に基づき、また、Gouy-Chapman理論により電気二重層が厚くなればなるほど電極間の電位差が上昇することが分かっている。つまり、低塩濃度水溶液中では電気二重層の厚みが増し、電位差は上昇し、高塩濃度水溶液中では電気二重層の厚みが減り、電位差は減少することになる。このことを利用してBrogioliらは海水と淡水の塩濃度差で電位差を生み出すことを考えた。活性炭電極に海水と同じ濃度である0.6 Mの高塩濃度水溶液と川水と同じ濃度である0.024 Mの低塩濃度水溶液を交互に流し、この濃度変化により33 mVの電圧変化を生み出すことが出来ることを報告した。
② CDP
CDLEはこれまでのPROやREDなどの塩濃度差を用いた発電法とは異なる新たな発電法であるが、電気二重層を形成させるための外部電圧が必要であることや、PROやREDと比較すると得られる電力密度が低いという課題があった。そこで、SalesらはCDLEにREDのように電極と溶液間にイオン交換膜を挟む発電法を提案した16。電極はCDLEと同じ活性炭電極を用いるが、正極側にアニオン交換膜、負極側にカチオン交換膜を使用する。膜間に生じる電位差を利用し、外部電圧を必要としないうえ、その分だけ大きな電力を獲得できる。この発電法では、膜間に電位が常に生じているためCDLEのように回路を開閉する必要はなく、連続的に測定を行うことも可能である。CDPはCDLEよりも大きな電力密度を獲得することが出来る。しかし、CDPではCDLEでせっかく解放された膜の問題、すなわち、長期間使用による汚れなどの付着により性能が落ちる問題や膜のコスト面での問題が再び浮上してしまう。そこで、膜を用いずCDLE の原理を基に電力密度の向上を図る方法として、Fernándezらは電極上にアニオン性およびカチオン性高分子を被覆した導電性電極に注目した17。アニオン性高分子としてポリナトリウム 4-スチレンスルホネート、カチオン性高分子としてポリジアリルジメチルアンモニウムクロライドを用いてセルを作製した時に50 mW/m2の最も大きな電力密度を獲得することができると報告している。ただし、電位の上昇に対する時間の応答が緩慢であり、その改善が必要である。
③ MEB (混合エントロピー電池)
CDLEとCDPでは多孔質な活性炭電極を用い、静電的にイオンを吸着させ、電気二重層を作り、この原理を基に電気エネルギーを獲得している。すなわち、イオンの物理的な移動を利用するコンデンサのようなものであり、化学反応を利用する電池のようなものではない。La Mantiaらは多孔質な活性炭電極ではなく、海水中のナトリウムや塩素の可逆的な酸化還元反応を行うことが出来る電極を用いることで電気エネルギーを獲得する発電法を提案した9。具体的にはNa2Mn5O10電極とAg/AgCl電極を用いた。両電極の反応を以下の①式に示す。溶液中のNaCl濃度に依存して平衡がずれる。
5MnO2+2Na++2e- ⇆ Na2Mn5O10 2AgCl+2e- ⇆ 2Ag+2Cl- ・・・①
このMEBでは電力密度は4つのstepから求められる(図3)。 要するに、塩濃度の低い条件(低電位差)で充電し、塩濃度の高い条件(高電位差)で放電していることになり、その際の電子移動によって行われる仕事の差が得られる電気エネルギーとなる。電気二重層の形成を利用するCDLEやCDPと比較して大きい電力密度が得られる。さらに、MEBは持続性にも優れており、この測定を100サイクル繰り返しても電力密度はほぼ低下しないと報告されている。また、MEBにはCDLEと同様にイオン交換膜を使わなくても良いというメリットがある。
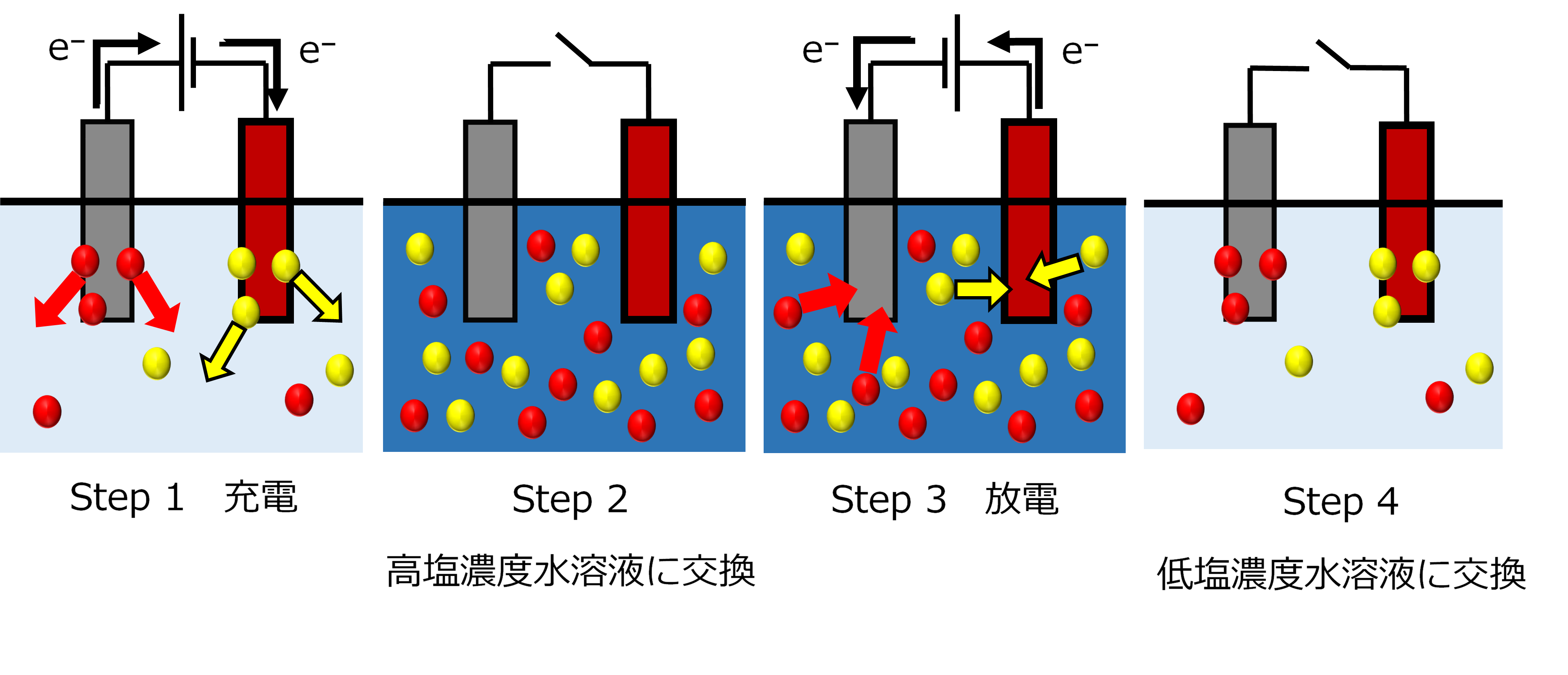
図3 MEBの電気エネルギー獲得プロセス(CAPMIXサイクル)。Step1: 低塩濃度水溶液に両電極を浸し、それぞれの電極からNa+とCl-が放出される向きに電流を流す(充電)。Step2: 次に回路を開き、溶液を高塩濃度水溶液に入れ替える。溶液中の塩濃度が上昇し、電極間の電位差が増加する。Step3: step1と逆向きに、電流を流す(放電)。Step4: 再度回路を開き、溶液を低塩濃度水溶液に入れ替えて元の状態に戻す。
3-2. 水/イオン液体混合系のLCST型相転移挙動を利用したMEB (IL-MEB)これまで報告されているMEBは、河口付近に電極を設置し、潮の満ち引きで生じる海水と淡水の塩濃度差を利用することを前提としているため、設置場所が限定される、電極反応するイオンがNa+、Cl-などに限られるなどの制約が生じていた。IL-MEBでは、それらの制約から解放され、場所やサイズによらなくなる。また対象とするイオンがLiイオンでも良いので、Liイオン二次電池の開発で改良された電極が使えるというメリットもある。水/イオン液体混合系の相転移前後で濃度変化するのはイオン液体を構成するアニオンとカチオンであるが、これらのイオンの酸化還元反応を行える電極は今のところ存在しない。そこで、この水/イオン液体混合系にNaClやLiClなどの無機塩を加えて、その無機イオンの相転移前後での濃度変化を利用することを考えた。最初はすぐにできると思っていたのだが、実際にやってみると予期しない事態が発生し、苦労した(している)。まずは、水/イオン液体混合系でLCST型相転移挙動を示す系に無機塩を加えていくと、相転移温度が変化することはもちろん、場合によってはLCST型相転移挙動を示さなくなる。そこで、ある程度の量の無機塩を加えてもLCST型相転移挙動を示し、実験室で簡単に相転移を起こすことのできる室温付近にLCSTが存在する条件を探さなければならない。まずは、無機塩を加えない場合にLCST型相転移挙動を示すことが分かっているtetrabutylphosphonium p-toluenesulfonate ([P4,4,4,4][TsO])と水との混合系18について、無機塩を加えた時の相挙動について調べた。その過程で、ある濃度以上の無機塩を加えたときに、昇温して二相になった時の各層の体積比が逆転するという現象が見られた(図4)。
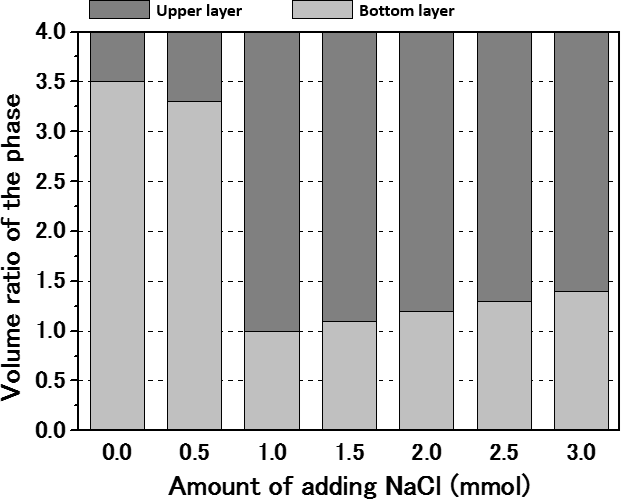
図4 [P4,4,4,4][TsO] (2 g)/水 (2 g)にNaClを添加した系のLCST以上で二相に分離したときの上層、下層の体積比。NaClの添加量が0.5 mmolまでは上層の体積が小さく、上層が水リッチ相であり、NaClの添加量が1.0 mmolを超えると下層が水リッチ相になり、下層の体積が小さくなる。
無機塩は水に溶解し、イオン液体に難溶であることから、各層への無機塩の分配比は各層の水の含有量に依存する。水に溶ける無機塩の量が多くなると、水リッチ相の比重が増し、イオン液体リッチ相との逆転が起こったことが原因であることが後に判明した。二相に分離したときにどちらの相に電極を挿入するかで、電力の獲得方法が逆になるので、注意が必要となる。この系では、昇温して二相に分離したときの上層のイオン液体リッチ相に電極を挿入して、発電サイクルを回した(図5)。
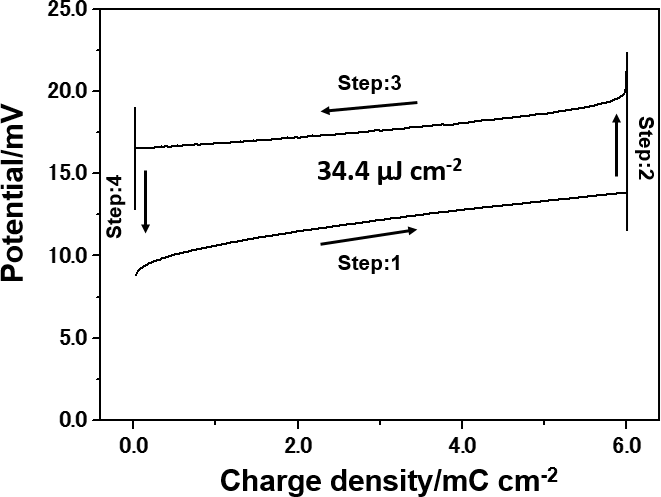
図5 IL-MEBの出力。 [P4,4,4,4][TsO](2 g)/水(2 g)に3 mmolのNaClを添加した系。この溶液は 32℃で LCST型相挙動を示した。この溶液が相分離した際の上層(イオン液体リッチ相)にNa2Mn5O10電極(0.5 cm2)とAgCl電極(0.5 cm2)を挿入し、セルを作製した。エネルギー密度の測定は、次の4つのStepにより行った。Step1: 相分離した状態で電極からNa+とCl-が放出される向きに10 µA/cm2の電流を5分間流した。Step2: 開回路により電流が流れない状態にし、29℃まで降温しながら撹拌することで相溶させた。Step3: Step1とは逆向きに-10 µA/cm2の電流を5分間流した。Step4: 再度、開回路により電流が流れない状態にし、撹拌を止め、32℃まで昇温することで溶液を相分離させた。
その際、無機塩の活量が大きくなるのは、一相の時で、二相では活量は小さくなる。得られたエネルギー密度は34.4 µJ/cm2、電力密度は19.1 nW/cm2であり、微々たるものであったが、ようやく発電できることを実証できた。そもそも、よく考えると(この段階で考えていてはいけないのだが)、無機塩が水のみに溶け、イオン液体には全く溶けないとすると、相転移前後での無機塩の分配は水の分配そのものになり、一相の時と二相の時の上層、下層のそれぞれの水に対する無機塩濃度はすべて同じにならなければならない。おそらく、上層と下層の水に対するイオン液体量の差か、あるいは、上層、下層の水とイオン液体の構造形成に差が生じたために、上層、下層の無機塩の分配にわずかに差が生じたことが原因であると考えられる。そもそも濃度ではなく活量で議論すべきであるが、濃厚な溶液の活量について測定することも、計算することもなかなか難しい。逆にこの系は無機塩の相転移前後の活量差を電気化学的に測定していると言えるのかもしれない。
その後、これまで、(i) イオン交換を抑止できる双性イオンでLCST型相転移挙動を示すものを用いた系、(ii) LCST型相転移挙動を示すイオン液体/水混合系と無機塩水溶液とを逆浸透膜を介して接触させた系、(iii) LCST型相転移挙動を示すポリイオン液体に逆浸透膜を介して水を吸脱着して無機塩の濃度変化を起こさせる系、などの研究を行ってきている。また、(iv) Liイオンを構成イオンとするイオン液体でLCST型相転移挙動を示すものが見つかった。当初のイオン液体を構成するイオンの、電極での吸脱着と酸化還元可能な系となるため、系がシンプルになること、温度変化に伴う大きなイオン濃度変化が期待できることから、注目している。これらの系についても、まとまり次第、改めて紹介したいが、ここでは一つだけ、(ii)の系の実験過程で、温度変化に伴うLCST型相転移挙動に対して、小さな発見があったことについて述べる。ここで調べている系を図6に示す。温度が低い状態では、逆浸透膜を隔てて右側のイオン液体/水混合系は一相であり、昇温して二相にした時、下層が水リッチ相になるような系を組んだ(純粋な水よりも比重の軽いイオン液体tributylhexadecylphosphonium 2-(trimethylsilyl)-1-ethanesulfonate ([P4,4,4,16][TMSES])を用いた)。その際、一相の時、イオン液体濃度が高く、二相にした時、イオン液体の濃度が低くなることから、図に示したように、一相の時に無機塩水溶液から浸透圧によってイオン液体水溶液側に水が移動することを想定していた。実際に組んでみると、一相のイオン液体水溶液が想定した通り(濃度通り)には水を吸い込んではくれないことが判明した。このことは、LCST型相転移挙動を示すようなイオン液体/水系では、均一に見えていても、イオン液体が水溶液中で、何らかの構造を形成し、実際の粒子数が、塩が完全解離したイオン数よりも少なくなっていることが原因であると考えられた。実際に、イオン液体の集合状態に影響を与えると考えられる界面活性剤などをイオン液体/水系に添加すると、浸透する水の量が増えることなどから、この仮説が正しいものと確信している。このことを逆に使うと、浸透圧を測定すれば、どの程度のイオン液体の集合体が生成しているのかを見積もることができることになる。目的とするMEBの出力は、集合体形成によって、抑制されることになり、添加剤を加えて改善するとしても、添加剤を加えることがLCST型相転移挙動そのものに影響を与えることになるため、注意が必要である。
以上述べたように、LCST型相転移挙動の本質が理解できないと、MEBの理論的な出力も予測できず、なかなか論文としてまとめづらい状態になっている。観測される現象を1つ1つ理解し、最終的にはIL-MEB全体の理想的なシステムが提案できるよう研究を進めていきたい。
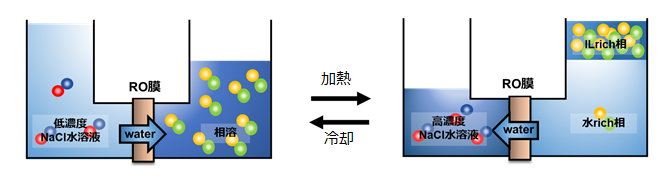
図6 逆浸透膜を隔ててNaCl水溶液とLCST型相転移挙動を示すイオン液体/水系を接触させている。左側がNaCl水溶液、右側がイオン液体/水混合溶液。加熱して二相分離させたときに下層が水リッチ相になる。
4. おわりに
ここではLCST型相転移挙動という興味深い現象に嵌まりつつある現状について報告した。簡単に言うと、イオン液体という新しい材料を用いて、エントロピーだの、浸透圧だの、活量だのといった熱力学の基本中の基本について、改めて実験的に検証しながら新しい装置を開発中ということになる。そもそも私自身が熱力学の基礎、溶液の化学が分かってないだけという気もしており、何当たり前のことを今更言ってるのかと思われる方には是非ともご助言いただければと思う。IL-MEBの理論的な出力はそれほど高くはならないと考えられるが、風力発電や太陽光発電の平準化に使われているレドックスフロー電池の代替にはなり得るのではないかと考えている。昼(高温時)に風力や太陽光で発電した電気により充電し、夜(低温時)に放電することを想定した装置である。レドックスフロー電池であれば、当然、入力した電力よりも出力する電力の方がロスによって小さくなるものと考えられるが、このIL-MEBでは、入力した電気エネルギーより、出力する電気エネルギーを大きくすることも可能になるものと期待される。入力した電気エネルギーより出力する電気エネルギーが大きいとは、エネルギー保存則は大丈夫か?と思われるかもしれないが、ここで上乗せされるエネルギーは、相転移に必要な熱エネルギーの一部であろう。つまり、相転移エンタルピーがこの装置の理論的な出力限界になるものと考えられる。得られるエネルギーはわずかかもしれないが、未利用のエネルギーを補助的に使うという考え方もあっても良いのではないかと思っている。思いついてから何年も経っているのにもかかわらず、まだ全然まとまっていない段階での紹介となってしまい、中途半端な内容になってしまったがご容赦いただきたい。
最後に、LCST型相転移挙動を示し、水よりも比重の小さいイオン液体である、[P4,4,4,16][TMSES]をご提供いただいた、日清紡ホールディングス株式会社の増田様、逆浸透膜をご提供いただいた東レ株式会社の小川様および佐々木様にこの場を借りて御礼申し上げる。
参考文献
- K. Fukumoto and H. Ohno, Angew. Chem. Int. Ed., 46, 1852-1855 (2007).
- Y. Kohno, H. Arai, S. Saita, and H. Ohno, Aus. J. Chem. , 64,1560-1567 (2011).
- K. Fujita, D.R. MacFarlane, M. Forsyth, M. Yoshizawa-Fujita, K. Murata, N. Nakamura, and H. Ohno, Biomacromolecules, 8, 2080-2086 (2007).
- H. Ohno, K. Fujita, and Y. Kohno, PCCP, 17, 14454-14460 (2015).
- K. Fujita, R. Nakano, R. Nakaba, N.Nakamura, and H. Ohno, Chem. Commun., 55, 3578-3581 (2019).
- Y. Kohno, S. Saita, K. Murata, N. Nakamura, and H. Ohno, Polymer Chem., 2, 862-867 (2011).
- Y. Kohno, N. Nakamura, and H. Ohno, Aust. J. Chem., 65, 1548-1553 (2012).
- K. Ikeda, R. Ikari, N. Nakamura, H. Ohno, and K. Fujita, J. Electrochem. Soc., 165, G96-G100 (2018).
- F. La Mantia, M. Pasta, H. D. Deshazer, B. E. Logan, and Y. Cui, Nano Lett., 11, 1810-1813 (2011).
- N. Boon and R. van Roij, Molecular Phys., 109, 1229-1241 (2011).
- J. Tollefson, Nature, 508, 302-304 (2014).
- M. Janssen, A. Hartel, and R. van Roij, Phys. Rev. Lett., 113, 268501 (2014).
- S. Loeb, J. Membrane Sci., 1, 49-63 (1976).
- R. E. Pattle, Nature, 174, 660-661 (1954).
- D. Brogioli, Phys. Rev. Lett., 103, 058501 (2009).
- B. B. Sales, M. Saakes, J. W. Post, C. J. N. Buisman, P. M. Biesheuvel, and H. V. M. Hamelers, Environ. Sci. Technol., 44, 5661-5665 (2010).
- M. M. Fernández, R. M. Wagterveld, S. Ahualli, F. liu, A. V. Delgado, and H. V. M. Hamelers, J. Power Sources, 302, 387-393 (2016).
- Y. Kohno, H. Arai, S. Saita, and H. Ohno, Aust. J. Chem., 64, 1560-1567 (2011).
