Topics
2024.03.30 circular No.22
イオン液体のバイオ研究 - 酵素研究から創薬研究へ -九州大学工学研究院 次世代経皮薬物送達研究センター
後藤 雅宏
イオン液体研究の中でも、バイオ関連の研究者はマイナーな方だと感じている。せっかく、Topics記事を書くような機会をいただいても、皆さんが興味ない記事になってしまっては残念である。そこで、学術的な総説調の記事ではなく、私のこれまでのイオン液体研究を、読み物ふうにまとめることにした。なお、「イオン液体の創薬応用」に関しては、最近の総説記事があるので、そちらを参照くだされば幸いである1-3)。
2.学生時代の研究を振り返って
私自身の学位論文は、バイオ研究とは全く異なる「乳化液膜によるレアメタルの抽出分離」に関する研究である。九州大学の卒研で配属された研究室が、たまたま分離工学の研究室であり、その当時、レアメタル、特に希土類金属の分離研究が流行っていた。研究室での実験は、溶媒(液液)抽出という大変地味な実験の繰り返しだった。毎日、水相に溶かした複数の希土類金属を、トルエンに溶かした抽出剤で抽出し分離していた。単純作業の繰り返しで、正直実験はあまり面白くなかった。しかし、選んだ抽出剤で希土類の選択性が大きく変化する現象に興味をもった。研究室は自由な雰囲気で、「抽出」というキーワードを外さなければ、なんでも自由にやらせてくれた。そこで、修士に入ると、何か新しいことをやろうと世界の文献を調査することにした。しかし、その当時はインターネットもなく、文献検索は大変な作業であった。大学の図書館に籠り、大きな電話帳のようなChemical Abstract(通称ケミアブと呼ぶ)からキーワード検索し、興味ある論文が見つかるとノートに書き写し、その論文をABC順に配架された地下の書庫(図1)に探しにいくという方法だった。お目当ての論文が見つかるとそのページに付箋をして、図書館の複写室でコピーをしていた。ネットの発達した今では考えられないが、外国の文献を入手するのは一日仕事であった。そこで、出会ったのが、MITのチームが提唱したエマルション抽出法であり、エマルション中の微小水滴に金属イオンを抽出すると、その体積比によって、一度に何十倍も濃縮できるという新たな抽出分離法だった4)。その後、私はこのエマルション抽出法を研究に取り入れ、このテーマで学位を取得した。この論文が、私の人生を大きく変える論文になるとは、その当時は全く予想だにしなかった。ちなみに、私の卒論・修論は手書き、学位論文は、ワープロの「書院」(シャープ製)で作成した。PCで文字を書くという時代は、その後1990年代にNECの伝説のマシンPC-9801が普及してからの話になる。

図1 九州大学旧中央図書館の書架(箱崎キャンパス)*九州大学附属図書館HP豊かな資料群より転載
3.バイオ研究との出会い九州大学の国武教授の紹介で、博士修了後は、アメリカのペンシルバニア大学に10月からポスドクに行く予定になっていた。その当時(1989年)の年棒は36,000$、1$は、120円程度だった。ところが、私が博士の3年の時に始まった日本学術振興会の特別研究員制度(PD)に前年応募した結果が、3月に届いた。結果は、採択だった。熟慮の末、そのまま九大に残ってポスドクを続けることになった。九大では、私が初めての学振の特別研究員となった。採択された学振の研究テーマは、「逆ミセルを用いたバイオ分子の抽出技術の開拓」だった。従来から、抽出技術は、金属イオンを分離する手法として工業的にも広く利用されていた。その中で、抽出技術を、バイオ分子に応用できないかと考えての提案であった。ところが、世界ではすでにそれを成し遂げた人がいることを後に知った。それが、先のエマルション抽出を提案したMITのHattonグループだった5)。彼らは、AOTというスルホン酸系のアニオン性界面活性剤でマイクロエマルションを作ると、水中で正に帯電したリゾチームがマイクロエマルションの内水相に移動し抽出されるという現象を発見していた(図2)。そこで我々も、まずは彼らの研究をお手本に研究を進めた。ポスドク1年目、世界溶媒抽出会議(ISEC1990:International Solvent Extraction Conference)が京都で開催されることになっていた。Plenary Lectureの候補を外国から4人選定することになり、私がMITのHatton教授を推薦した結果、その提案が認められた。私が交渉することになったが、インターネットがない時代の交渉は困難を極めた(日本でインターネットが導入されたのは1994年頃だった)。その頃、意外と便利だったのは、国際電話によるFAXのやり取りだった。ボストンとは時差が13時間、FAXを送った次の朝、秘書のCarolという方から、OKのFAXが届いた時は嬉しかった。後に、私はこの京都の国際会議でHatton教授のお世話をしたことがきっかけで、1994年からMITのHatton研究室に留学することになった。
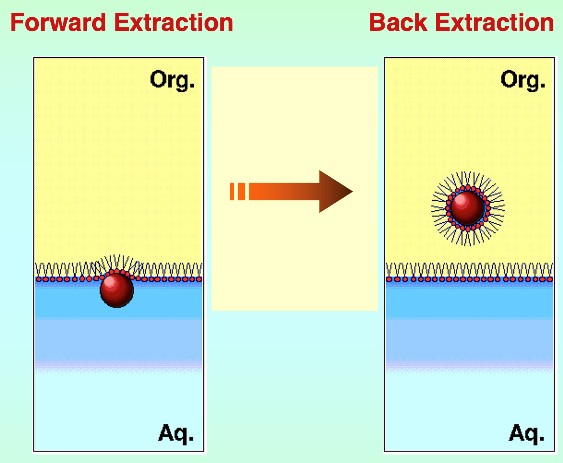
図2 MITのチームが提案した逆ミセルを用いるタンパク質の抽出操作5)
4.MITへの留学
1994年の6月29日に、ボストンに到着した。空港に、Hatton教授が迎えにきてくれ、そのまま研究室に連れて行ってくれた。教授室の扉を開けると、左手にちょっとBigな女性が座っていた。Hi Masahiro、そう、この方が秘書のCarolさんだった。その後、Carolさんには色々お世話になった。Hatton教授から、ここで何がやりたい?と聞かれ、逆ミセルでタンパク質抽出をやりたいと返答した。ところが、逆ミセルにタンパク質を抽出すると、抽出されたタンパク質は、その高次構造が変化して変性してしまうことが問題となって、研究をやめてしまったとの回答だった。そこで、この問題を解決するために、抽出してもタンパク質が変性しないような逆ミセルの開発をさせて欲しいと申し出て、MITでの研究を開始した。タンパク質の変性の原因は、逆ミセル形成に使用するスルホン酸系の界面活性剤AOTにあると感じていたので、新たにタンパク質抽出用の界面活性剤を合成することにした。結果的に、疎水部に2本の長鎖オレイル基を導入したリン酸型の界面活性剤(DOLPA:Di-Oleyl Phosphoric Acid)が、安定な逆ミセルを形成し、タンパク質の高い活性を保持できることを明らかにした6)(図3)。これらの成果に基づき、「Design of Surfactants Suitable for Protein Extraction by Reversed Micelles」という共著論文を発表することができた7)。Hatton研究室では、逆ミセルを分離の場として利用するより、反応の場としての利用に興味が移っていた。その意味で、我々が開発した新しい逆ミセルは、有機溶媒中で、酵素の高い活性を保持するために役立った8)。さらに、逆ミセルのナノ空間が、変性したタンパク質のリフォールディング場として、機能することを見出した9)。MITで強く感じたことは、日本の大学では、ある程度実験が終わってから、論文をどう書こうかと考えるが、MITでは、論文の構想を練りながら(すでに論文のストーリーは決まっている)実験すると言う感覚だった。

図3 新しくタンパク質抽出用に開発したDOLPAによるヘモグロビンの抽出6)(AOTではタンパク質の変性が見られるが、DOLPAを使用すると変性が見られない)
5.イオン液体との出会い
帰国後は、MITで開発した逆ミセルを利用し、有機溶媒に溶かした様々な酵素の反応に没頭した。その当時は、有機溶媒中の酵素反応がブームであった。一方で、帰国後も同じ研究室の助教授(今の准教授)として復帰したので、学生の抽出研究の指導を続けていた。ある日抽出グループの文献紹介で、1998年アラバマ大のRogersのグループが、抽出溶媒を有機溶媒からイオン液体[bmin][PF6]に代えるという論文が紹介された10)。抽出分離は、水と有機相間の分配比を利用して物質を分けるという単位操作であるが、水と混和しない塩溶液が存在するという事実に驚いた。まさに第3の液体との出会いであった。その後研究室では、1999年の卒論テーマとして、イオン液体を抽出研究に取り入れた。また、有機溶媒中の酵素研究が活発になる中、研究室でも当然のごとく、2000年の卒論テーマとして、「イオン性液体中での酵素反応の検討」を開始した。その当時は、西川先生の特定領域でイオン液体が定義される前で、研究室ではまだ、「イオン性液体」と呼んでいた。2000年に入るとやはり誰が最初にイオン液体中の酵素反応を発表するかに注目が集まっていた。その後、ついに2000年の12月に、オランダのSheldonグループが、イオン液体[bmim][BF4]中での酵素反応(リパーゼ)を発表した11)。また、2001年に入ると、日本の伊藤先生12)とドイツのKraglグループ13)がほぼ同時期に、イオン液体中でのリパーゼによる不斉反応を報告している。これ以降、すごい数のイオン液体を利用した酵素反応が報告された。我々も、2002年の6月に、イオン液体[omim][PF6]中で、リパーゼをPEGでコーティングすることによって酵素の分散性を向上させ、活性が大幅に増大することを発表した14)。このように、我々の酵素研究の特徴は、酵素の表面を界面活性剤などで被覆することで、イオン液体中への酵素の分散性(溶解度)を上げる工夫にあった。中でもPEG修飾は、様々なイオン液体と相性が良く、多くの酵素をイオン液体中で活性化させるのに有効であった15)(図4)。酵素反応場としてのイオン液体の魅力は、非水溶媒なので、リパーゼなどの加水分解酵素の逆反応すなわち合成反応の場となり得ること、そして、溶解性が高いため、様々な基質が利用できる点にある。一方で、工業利用を検討した際に、最終生成物の取り出しと単離精製の難しさが課題となった。我々も、イオン液体中の酵素反応に関しては、2010年にこれまでの成果を総説としてまとめ16)、一時撤退することにした。ただ、この時に発表した総説は、現在引用回数が500回を超えて、自身の論文の最高引用数を記録している。
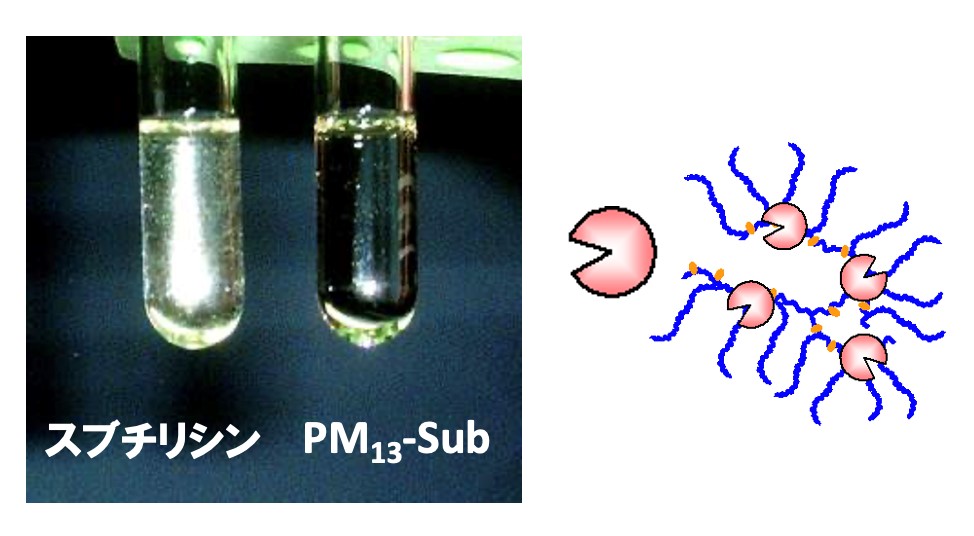
図4 酵素のPEG修飾によるイオン液体[emim][Tf2N]への溶解15)
6.イオン液体による創薬研究のはじまり
イオン液体を利用したDDS(Drug Delivery System)研究のはじまりは、2007年のRogersらの報告であり17)、薬をイオン液体化するという手法である。具体的にはリドカインという麻酔薬をカチオンとし、ジオクチルスルホコハク酸をアニオンとしたイオン液体などが報告されている。これらはカチオンとアニオンの双方が薬効を示し、これらの相乗効果が期待されることから、Active Pharmaceutical Ingredient-based Ionic Liquid(API-IL)としてその後、多くの研究が行われるようになった。翌2008年、ロンドン大学の研究チームが、難溶解性薬物であるAlbendazoleとDanazol について、イオン液体[bmim][PF6]を用いると、その溶解性が1万倍向上することを示している18)。その後、イオン液体の創薬研究は、薬剤をイオン液体化する手法と溶解剤として使用する手法に大きく分類された。さらに、イオン液体利用の三つ目は、イオン液体を経皮吸収促進剤として利用する手法である。イオン液体の経皮促進機能に関しては、我々の研究グループが、2010年に難溶解性薬物アシクロビルをモデル薬物として、イオン液体エマルションを利用した経皮吸収促進挙動を最初に報告した19)。
イオン液体の薬物応用には、2つの大きな特色がある。一つは、イオン液体研究者が、薬物応用に入っていく場合、もう一方は、薬学研究者が、イオン液体利用を試みる場合である。それぞれの論文を読んでいると、その立場がよくわかる。私たちの研究グループは、2008年JSPSの海外特別研究員としてバングラデッシュからMuhammad Moniruzzaman氏(現ペトロナス大学准教授)を招聘した。彼は、有機溶媒中の酵素反応が専門で、学振採択のテーマは、「イオン液体中の酵素反応制御」であった。イオン液体中で、いかに酵素の活性を増大させるかが彼のテーマであった。一方で、同時期に博士の学生として田原義朗君(現同志社大学准教授)がいて、隣で、DDS研究をやっていた。やはり、大きく研究を転換する場合には、異分野融合が鍵を握ると感じている。創薬研究の最大の課題は、in vitro試験からin vivo試験(動物試験)への展開である。創薬研究は、動物試験において、試験管や細胞実験とは大きく異なる結果が得られることがしばしばある。研究室では、Monir氏の調製したイオン液体製剤を、田原君が動物試験をすることで、イオン液体の創薬研究が飛躍的に発展した。2013年7月、初めてイオン液体を使って動物試験を開始した。翌朝、学生が動物室から飛んで帰ってきた。マウスが1日で死んでしまいました。Monir氏は、典型的なイオン液体研究者で、薬に関しては全くの素人だった。イオン液体研究者の多くは、まずイミダゾリウムカチオン誘導体から試したがるので、彼の最初のサンプルも[omim]ベースのイオン液体製剤だった。イオン液体の創薬応用において、薬物の生体安全性の重要性を思い知らされた1日であった。その後、イオン液体の使用量を最小限(5%)に抑え、イオン液体[C12mim][Tf2N]を添加することによって、ワクチンの増大効果を確認できたのは1年後の夏であった20)(図5)。
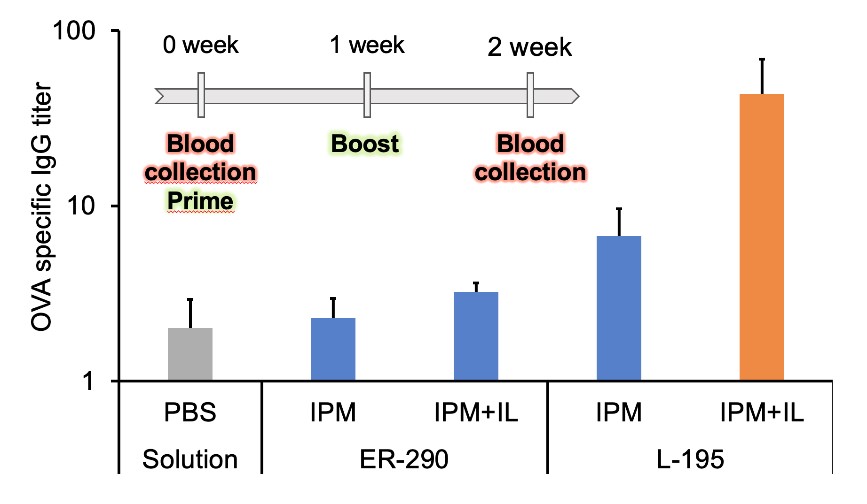
図5 イオン液体([C12mim][Tf2N])による経皮ワクチンの増強効果20)(ワクチン抗原としてOVAを使用、IPM:イソプロピルミリステート、ER-290およびL-195はスクロース型の界面活性剤)
7.創薬研究のための生体適合性イオン液体
イオン液体を利用した創薬研究において、初期の頃はイミダゾリウム系のイオン液体を用いた例がほとんどであった。しかしながら、イミダゾリウムカチオンは毒性が高く、実際の医療現場での利用は困難であると、製薬企業の研究者から伝えられた。実際に臨床応用を目指すためには、安全性の高いイオン液体を開発することが必須となる。すでに、Hela細胞などをモデルとしたイオン液体の毒性評価に関する研究は行われており、毒性に及ぼすイオン液体の分子構造に関する議論も進んでいる21)。なかでも、カチオン分子においては、コリンを用いたイオン液体が、安全性の観点から好まれている。2014年にハーバード大のMitragotriらは様々なイオン液体によって、低分子薬の経皮吸収が促進されるかどうかについて検討を行った22)。その中で、コリンとゲラン酸がモル比1:2で形成するイオン液体(CAGE)が、高い経皮吸収促進効果を示すことを報告している(図6a)。その後、コリン-ゲラン酸は分子量の大きなインスリンやアルブミンなどのタンパク質についても経皮吸収促進効果を示すことが明らかにされている。
2005年に大野らによって、カチオンはイミダゾリウム系の[C2mim]であるが、アニオンをアミノ酸としたイオン液体が開発された23)。このイオン液体は20種類の天然アミノ酸すべてにおいて、ガラス転移温度が室温以下のイオン液体であり、生体適合性のアミノ酸を使用したイオン液体として注目を浴びた。その後、2007年にはコリンをカチオン、アミノ酸であるプロリンをアニオンとしたイオン液体が報告された24)。現在では、コリン-アミノ酸からなるイオン液体が広く利用され、カチオンとアニオンの両方が生体由来の分子である典型的な生体適合性イオン液体として注目されている(図6b)。コリンは、代表的な安全性の高いカチオン分子であり、2017年には、コリンを用いたイオン液体の総説も報告されている25)。我々も2018年に、コリン-アミノ酸(グリシン、アラニン、プロリン、フェニルアラニン、イソロイシン、セリン、ロイシン)からなるイオン液体を合成し、難水溶性の抗がん剤であるパクリタクセルを可溶化して薬物動態検討した26)。さらに、脂肪酸も生体由来のアニオンとしては代表的な分子の一つであり、コリンをカチオン、脂肪酸をアニオンとしたイオン液体も生体適合性の高いイオン液体として注目されている(図6c)。2019年に我々は、コリンをカチオン、オレイン酸(C18:1)、リノール酸(C18:2)、エルカ酸(C22:1)をアニオンとしたイオン液体を合成し、それぞれの水中における臨界ミセル濃度や細胞毒性などを検討した27)。臨界ミセル濃度については、疎水基の長いエルカ酸が最も低く、全てのイオン液体が界面活性剤として機能することを明らかにした。細胞毒性については、コリン-オレイン酸が最も低い細胞毒性であることを示した28)。
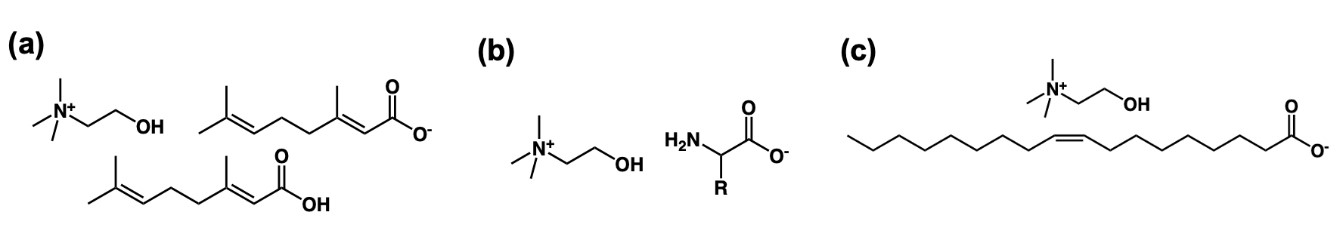
図6 生体適合性の高いイオン液体 (a)コリンーゲラン酸(CAGE)、(b)コリンーアミノ酸、(c)コリンーオレイン酸

図7 COIL-9(リヨン)のランチ会場にて CAGEを開発したハーバード大のSamir Mitragotri教授と
我々は、現在注射で投与されているインスリンを、イオン液体を用いて塗り薬(経皮製剤)にすることを試みた29)。インスリンは、コリンとプロピオン酸からなるイオン液体[Cho][C3]に溶解することを明らかにし、溶解したインスリンは、高次構造を維持することを確認した(図8A)。インスリンの皮膚透過を促進するために疎水的環境を付与することが重要である。そこで、インスリンを溶解した[Cho][C3]と、油状基剤であるIPM(イソプロピルミリステート)、さらにイオン液体(コリンー脂肪酸)を界面活性剤として用いてIonic Liquid-in-Oil(IL/O)エマルションを調製した。このIL/O製剤を用いてインスリンの皮膚浸透性を評価すると、インスリンは、高い経皮浸透性を示すことが明らかとなった。そこで、調製したインスリンのIL/O製剤を、糖尿病マウスへ経皮投与し、注射投与した場合との薬物動態を検討した。その結果を図8Bに示す。インスリンを注射した場合は、血糖値が急激に低下するが、数時間でその値も元に戻った。一方、イオン液体を塗布した場合、初期の血糖値の低下速度は注射に劣るものの、血糖値の低下効果は長期にわたって持続した。このように、インスリンなどのバイオ医薬品に関して、イオン液体が優れた経皮吸収促進効果を発揮することが明らかとなった。
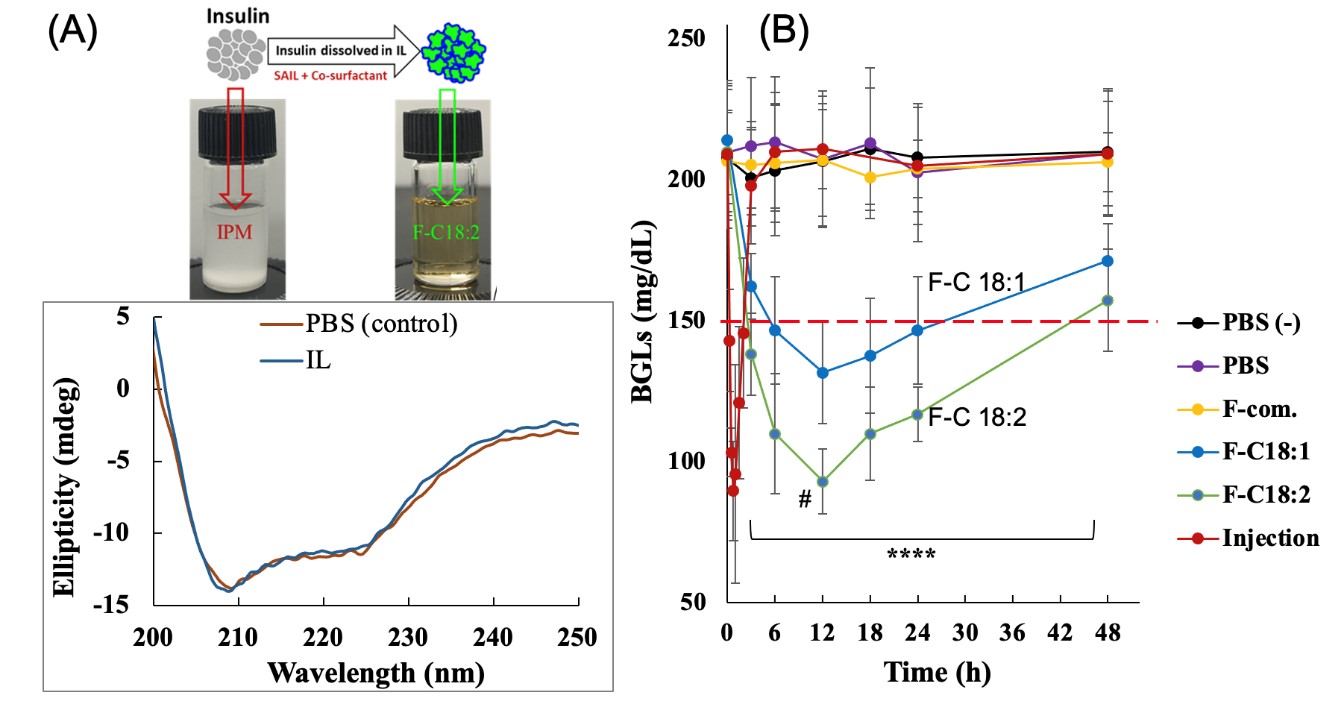
図8 イオン液体中に可溶化したインスリンのCDスペクトル(A)とイオン液体インスリンの経皮投与による血糖値の低下効果29)F-C18:1はコリン-オレイン酸、18:2はリノール酸
8.オン液体の核酸医薬への応用展開
我々は、コリン以外のカチオンとして、生体脂質をカチオン部とし、長鎖脂肪酸と組み合わせた生体適合性の高いイオン液体を新たに開発した30)(図9)。これら脂質由来のイオン液体は、核酸医薬とLNP(Lipid Nano Particles)類似の安定な複合体を形成し、核酸の経皮吸収を促進するのみならず、トランスフェクション機能(核酸を細胞内へ導入する機能)を示すことを最近明らかにした31)。
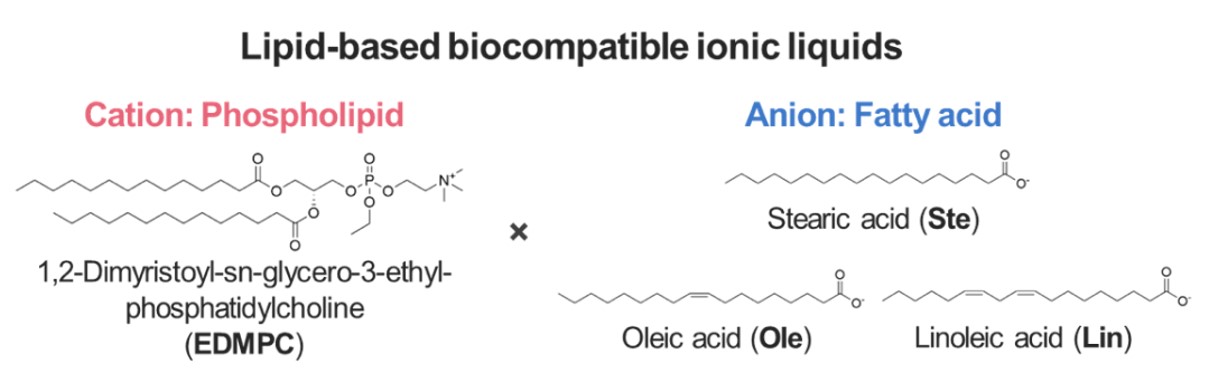
図9 核酸の経皮デリバリー用に開発された脂質由来イオン液体
最近の核酸医薬の発展は目覚ましく、医薬品開発の新たなモダリティとして注目されている。しかしながら、核酸医薬の投与法は現在のところ注射に限られている。注射投与は、医療従事者を必要とすることから、発展途上国など医療機関の乏しい国々では、注射に代わる簡易な投与法が求められている。そこで我々は、核酸の経皮吸収製剤の開発に着手した。核酸医薬には、通常の薬と大きく異なる点がある。それは、核酸医薬を機能させるためには、経皮吸収させるのみならず、透過後に核酸が細胞内へ取り込まれることが重要となる。つまり、核酸の経皮吸収技術を開発するには、核酸を皮膚から透過させるのみならずトランスフェクション機能も必須となる。そこで、我々は脂質由来のイオン液体に着目し、経皮吸収性とトランスフェクション機能の両面から最適なイオン液体を設計した。その結果、開発したイオン液体[EDMPC][Lin]が、オリゴ核酸の経皮浸透を促進し、さらにトランスフェクション機能があることを見出した。具体的なモデル薬として、アンチセンスオリゴ核酸のトラベデルセンを対象として、脂質由来のイオン液体を用いて調製した経皮製剤による皮膚透過性を検討した結果、リノール酸をアニオン部に持つイオン液体が最も透過性を増大させることを明らかにした。さらに、この脂質由来のイオン液体を用いて調製した経皮吸収製剤は、動物実験において、注射と匹敵するような制ガン効果を示すことを確認している31) (図10)。このように、イオン液体の核酸医薬への応用は、緒に就いたばかりではあるが、核酸医薬開発の新たな材料として期待される。
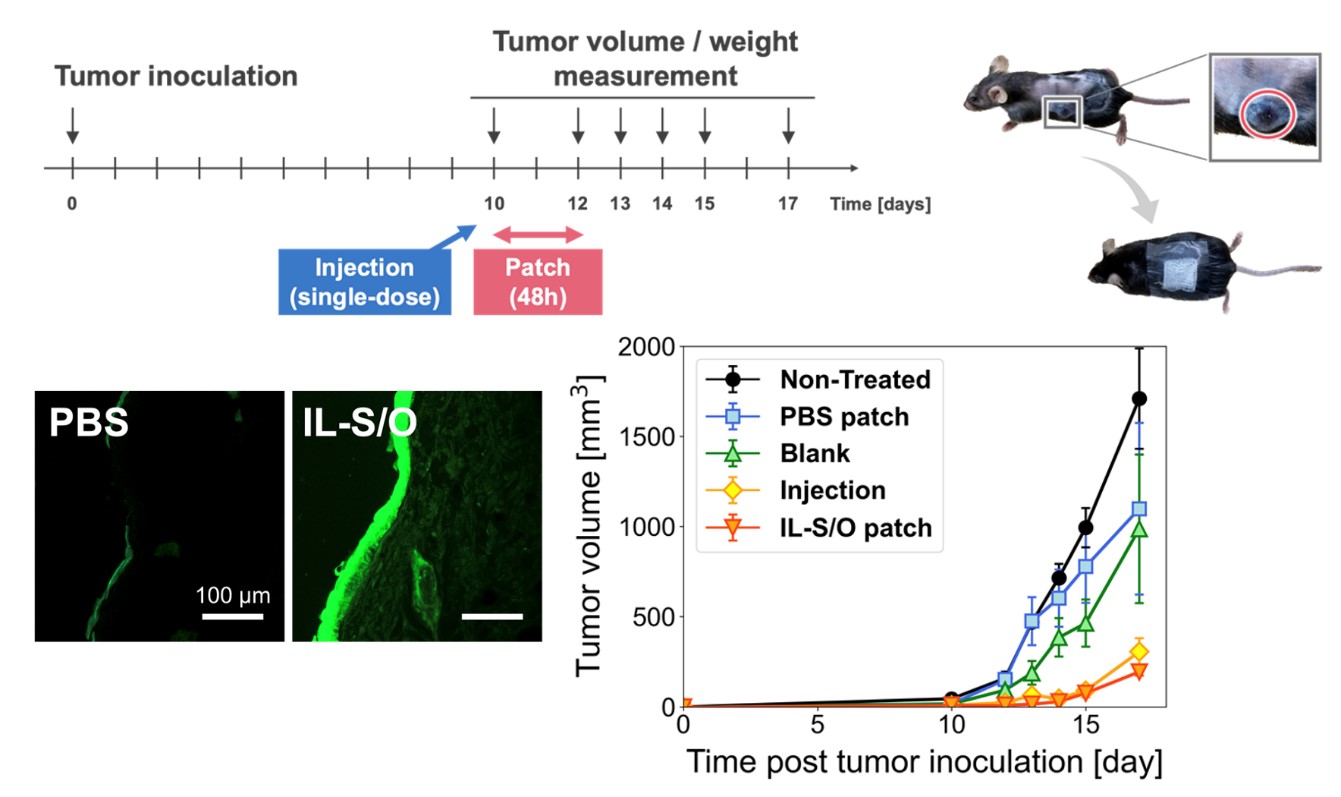
図10 脂質由来イオン液体によるアンチセンスオリゴDNAの制ガン効果31)
9.おわりに
イオン液体の薬物応用においては、様々な優れた機能が明らかにされている。ただ、イオン液体の工業利用においては、高純度のイオン液体提供が鍵を握ると考えている。西川先生の特定領域研究「イオン液体の科学」においても、微量の不純物がしばしば大きな影響を及ぼすことが問題視されていたが、創薬研究においては、さらにイオン液体の品質管理が重要となる。特に、薬に使用する材料となると、GMP基準での厳しい生産と管理が義務付けられており、そのハードルは高い。現状は残念ながら、薬物原料として認可されているイオン液体は存在しない。イオン液体研究も20年が過ぎ、学術研究から工業応用への期待が高まっている。我々も諦めずに、もう少し社会実装の夢に向かって挑戦したいと考えている。
謝辞:本研究を遂行するにあたり、2度の基盤研究S(2012~2020)と基盤研究A(2021~2026)さらに2度の挑戦的研究(開拓)(2019~2024)のご支援を頂いた。この場を借りて心より謝意を表する。
参考文献
- 後藤雅宏, Drug Delivery System 38 (3), 220 (2023)
- RM. Moshikur, M. Goto, The Chemical Record, e202300026 (2023)
- RM. Moshikur, M. Goto et. al., Pharmaceutics,15(4), 1179 (2023)
- M.P.Thien, TA. Hatton, D.I.C. Wang, ACS Symp. Ser., 314, 67 (1986)
- KE. Cöklen, TA. Hatton, Biotech. Prog, 1 (1), 69 (1985)
- T. Ono, M. Goto, TA. Hatton, Biotech. Prog, 12 (6), 793 (1996)
- M. Goto, T. Ono, TA. Hatton, Biotech. Bioeng , 54 (1), 26 (1997)
- M. Goto, TA. Hatton, Biotech. Prog, 14 (5), 729 (1998)
- M. Goto, TA. Hatton, Biotech. Bioeng, 57 (5), 620 (1998)
- JG. Huddleston, AE. Visser, RD. Rogers, Chem. Commun., 1765 (1998)
- R.M. Lau, F. van Rantwijk, K.R. Seedon & R.A. Sheldon, Org. Lett., 2, 4189 (2000)
- T. Itoh, E. Akasaki, K. Kudo, S. Shirakami, Chem. Lett., 262 (2001)
- S. H. Schofer, N. Kaftzik, P. Wasserscheid, U. Kragl: Chem. Commun., 425 (2001)
- T. Maruyama, S. Nagasawa & M. Goto, Biotechnol. Lett., 24, 1341 (2002)
- K. Nakashima, T. Maruyama, N. Kamiya, M. Goto, Chem. Commun., 4297 (2005)
- M. Moniruzzaman, K. Nakashima, N. Kamiya, M. Goto, Biochem. Eng. J., 48 (3), 295 (2010)
- W L. Hough, RD. Rogers et. al., New J. Chem., 31, 1429 (2007)
- H. Mizuuchi, V. Jaitely, S. Murdan, AT. Florence, Eur. J. Pharm. Sci., 33, 326 (2008)
- M. Moniruzzaman, M. Goto, et. al., Chem. Commun., 46, 1452 (2010)
- S. Araki, M. Goto, et. al., MedChemComm., 6 (12), 2124 (2015).
- N. Adawiyah, et. al., MedChemComm, 7, 1881 (2016)
- M. Zakrewsky, et. al., PNAS, 111, 13313 (2014)
- K. Fukumoto,H. Ohno et. al., J. Am. Chem. Soc., 127, 2398 (2005)
- S. Hu, et. al., Tetrahedron Lett., 48, 5613 (2007)
- BL. Gadilohar, GS. Shankarling, J. Mol. Liq., 227, 234 (2017)
- MR. Chowdhury, M. Goto, et. al., Mol. Pharm., 15, 2484 (2018)
- MK. Ali, M. Goto, et. al., J. Colloid Interface Sci., 551, 72 (2019)
- Y. Tahara, M. Goto, et. al., Mol. Pharm., 17, 3845 (2020)
- MR. Islam, M. Goto et. al., ACS Appl. Mater. & Inter., 13, 42461 (2021)
- S. Uddin, M. Goto, et. al., Chem. Commun., 56, 13756 (2020)
- K. Toyofuku, M. Goto et. al., ACS Appl. Mater. & Inter., 15, 33299 (2023)
